1. konsep laju reaksi
Laju
menyatakan seberapa cepat atau seberapa lambat suatu proses
berlangsung. Laju juga menyatakan besarnya perubahan yang terjadi dalam
satu satua waktu. Satuan waktu dapat berupa detik, menit, jam, hari atau
tahun.
Reaksi kimia adalah proses perubahan zat pereaksi menjadi produk. Seiring dengan bertambahnya waktu reaksi, maka jumlah zat peraksi semakin sedikit, sedangkan produk semakin banyak. Laju reaksi dinyatakan sebagai laju berkurangnya pereaksi atau laju terbentuknya produk.
Reaksi kimia adalah proses perubahan zat pereaksi menjadi produk. Seiring dengan bertambahnya waktu reaksi, maka jumlah zat peraksi semakin sedikit, sedangkan produk semakin banyak. Laju reaksi dinyatakan sebagai laju berkurangnya pereaksi atau laju terbentuknya produk.
2. Ungkapan Laju Reaksi untuk Sistem Homogen
Untuk sistem homogen, laju reaksi umum dinyatakan sebagai laju penguragan konsentrasi molar pereaksi atau laju pertambahan konsentrasi molar produk untuk satu satuan waktu, sebagai berikut:


Jika diketahui satuan dari konsentrasi molar adalah mol/L. Maka satuan dari laju reaksi adalah mol/L.det atau M/det.
3. Laju Rerata dan Laju Sesaat
a. Laju rerata
Laju rerata adalah rerata laju untuk selang waktu tertentu. Perbedaan antara laju rerata dengan laju sesaat dapat diandaikan dengan laju kendaraan. Misalnya suatu kendaraan menempuh jarak 300 km dalam 5 jam. Laju rerata kendaraan itu adalah 300 km/5 jam = 60 km/jam. Tentu saja laju kendaraan tidak selalu 60 km/jam. Laju sesaat ditunjukkan oleh speedometer kendaraan.
b. Laju Sesaat
Laju sesaat adalah laju pada saat tertentu. Sebagai telah kita lihat sebelumnya, laju reaksi berubah dari waktu ke waktu. Pada umumnya, laju reaksi makin kecil seiring dengan bertambahnya waktu reaksi. oleh karena itu, plot konsentrasi terhadap waktu berbentuk garis lengkung, seperti gambar di bawah ini. Laju sesaat pada waktu t dapat ditentukan dari kemiringan (gradien) tangen pada saat t tersebut, sebagai berikut.
- Lukis garis singgung pada saat t
- Lukis segitiga untuk menentukan kemiringan
- laju sesaat = kemiringan tangen

2. teori tumbukan
Mengapa kenaikan
suhu, penambahan luas permukaan, peningkatan konsentrasi, dan penambahan
katalis dapat mempengaruhi laju reaksi? Salah satu teori yang dapat
menjelaskannya dikenal dengan nama “teori tumbukan”.
1. Hubungan Faktor-Faktor yang Mempercepat Laju Reaksi dengan Teori Tumbukan
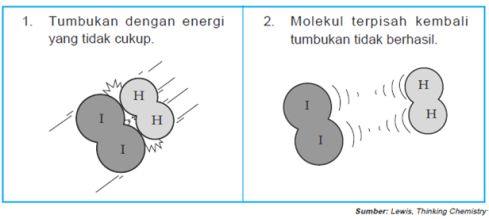
Tumbukan antara pereaksi ada yang menghasilkan reaksi dan tidak,
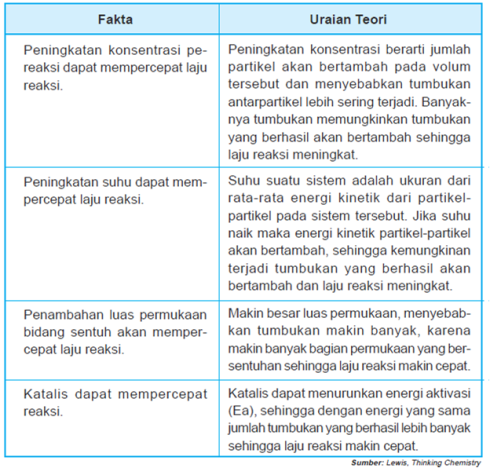
sebagai contoh amati gambar reaksi antara hidrogen dan iodium berikut:Untuk mengetahui teori tumbukan menjelaskan faktor-faktor yang mempengaruhi laju reaksi, Perhatikan Tabel berikut:
Tabel : Hubungan faktor-faktor yang mempercepat laju reaksi dengan teori tumbukan
Berdasarkan teori tumbukan, suatu
tumbukan akan menghasilkan suatu reaksi jika ada energi yang cukup.
Selain energi, jumlah tumbukan juga berpengaruh. Laju reaksi akan lebih
cepat, jika tumbukan antara partikel yang berhasil lebih banyak terjadi.
2. Energi Aktivasi
Pada kenyataannya molekul-molekul dapat
bereaksi jika terdapat tumbukan dan molekul-molekul mempunyai energi
minimum untuk bereaksi. Energi minimum yang diperlukan untuk bereaksi
pada saat molekul bertumbukan disebut energi aktivasi. Energi aktivasi
digunakan untuk memutuskan ikatan-ikatan pada pereaksi sehingga dapat
membentuk ikatan baru pada hasil reaksi. Misalnya energi aktivasi pada
reaksi gas hidrogen dan iodium dengan persamaan reaksi:
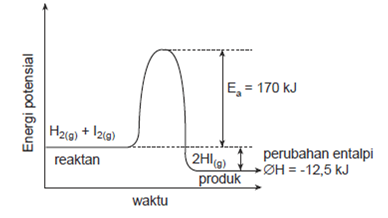
digambarkan pada grafik sebagai berikut.
Energi aktivasi pada reaksi tersebut
adalah 170 kJ per mol. Untuk terjadi tumbukan antara H2 dan I2
diperlukan energi ≥170 kJ. Pada saat reaksi terjadi energi sebesar 170
kJ diserap dan digunakan untuk memutuskan ikatan H – H dan I – I
selanjutnya ikatan H – I terbentuk. Pada saat terbentuk H – I ada energy
yang dilepaskan sehingga reaksi tersebut termasuk reaksi eksoterm.
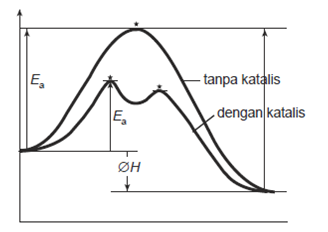
Untuk mengetahui bagaimana kerja katalis sehingga dapat mempercepat reaksi, Perhatikan Gambar berikut:
Pada Gambar diatas, proses reaksi tanpa
katalis digambarkan dengan satu kurva yang tinggi sedangkan dengan
katalis menjadi kurva dengan dua puncak yang rendah sehingga energi
aktivasi pada reaksi dengan katalis lebih rendahdaripada energi aktivasi
pada reaksi tanpa katalis. Berarti secara keseluruhan katalis dapat
menurunkan energi aktivasi dengan cara mengubah jalannya reaksi atau
mekanisme reaksi sehingga reaksi lebih cepat.
sumber :http://rinioktavia19942.wordpress.com
3. kesetimbangan
 Pengisian
aki merupakan salah satu aktivitas yang sering dilakukan di bengkel.
Reaksi kimia yang terjadi pada saat pengisian aki berjalan dua arah,
sehingga tercapai kesetimbangan pada kondisi tertentu.
Pengisian
aki merupakan salah satu aktivitas yang sering dilakukan di bengkel.
Reaksi kimia yang terjadi pada saat pengisian aki berjalan dua arah,
sehingga tercapai kesetimbangan pada kondisi tertentu.
Suatu reaksi kimia dikatakan setimbang,
jika jumlah unsur-unsur pereaksi dan hasil reaksi adalah sama.
Kesetimbangan dalam reaksi kimia meliputi kesetimbangan dinamis,
homogen, dan heterogen. Dalam kesetimbangan tersebut berlaku tetapan
kesetimbangan yang dinyatakan dengan Kc dan Kp.
Terbentuknya kesetimbangan reaksi dipengaruhi oleh beberapa faktor.
Faktor-faktor itu bisa digunakan untuk menentukan arah pergeseran
kesetimbangan reaksi. Prinsip kesetimbangan reaksi tidak hanya kita
temui dalam bidang studi kimia saja, tetapi juga di bidang industri.
Salah satu prinsip yang dipakai yaitu pemilihan suhu optimum dalam
memproduksi bahan-bahan kimia. Sehingga produk yang dihasilkan mempunyai
nilai ekonomis yang tinggi.
faktor yang mempengeruhi pergeseran kesetimbangan
Suatu sistem kesetimbangan dapat
berubah, jika mendapat pengaruh dari luar. Perubahan tersebut bertujuan
untuk mencapai kesetimbangan baru, sehingga disebut pergeseran
kesetimbangan. Hal ini sesuai dengan hasil penelitian yang dilakukan
oleh Henry Louis Le Chatelier.
1. Pengaruh Konsentrasi terhadap Kesetimbangan
Berdasarkan percobaan di atas, kalian
mengetahui bahwa perubahan konsentrasi memengaruhi pergeseran
kesetimbangan. Perubahan konsentrasi terjadi karena konsentrasi pereaksi
ditambah atau dikurangi. Apabila konsentrasi pereaksi ditambah, reaksi
bergeser ke kanan atau ke arah produk. Sedangkan jika konsentrasi
pereaksi dikurangi, reaksi bergeser ke arah kiri atau ke arah pereaksi,
sehingga konsentrasi pereaksi bertambah.
 2. Pengaruh Suhu
2. Pengaruh SuhuKesetimbangan reaksi juga dapat bergeser karena pengaruh suhu. Perhatikan reaksi berikut:
 Jika
reaksi tersebut dituliskan dalam persamaan termokimia,maka reaksi yang
ke kanan merupakan reaksi eksoterm dan reaksi yang kekiri merupakan
reaksi endoterm
Jika
reaksi tersebut dituliskan dalam persamaan termokimia,maka reaksi yang
ke kanan merupakan reaksi eksoterm dan reaksi yang kekiri merupakan
reaksi endoterm Pada
reaksi di atas, apabila suhu diturunkan, gas menjadi tidak berwarna dan
kesetimbangan bergeser kearah N2O2 yang tidak berwarna (kearah eksoterm
dengan melepaskan kalor). Apabila suhu dinaikkan gas berwarna coklat,
karena kesetimbangan bergeser ke arah NO2 yang berwarna coklat (kearah
endoterm dengan cara menyerap kalor).
Pada
reaksi di atas, apabila suhu diturunkan, gas menjadi tidak berwarna dan
kesetimbangan bergeser kearah N2O2 yang tidak berwarna (kearah eksoterm
dengan melepaskan kalor). Apabila suhu dinaikkan gas berwarna coklat,
karena kesetimbangan bergeser ke arah NO2 yang berwarna coklat (kearah
endoterm dengan cara menyerap kalor). Selain konsentrasi dan suhu, ternyata tekanan dan volume juga mempengaruhi pergeseran kesetimbangan.
Selain konsentrasi dan suhu, ternyata tekanan dan volume juga mempengaruhi pergeseran kesetimbangan.
3. Pengaruh Tekanan dan Volume
Sistem kesetimbangan gas mempungai
tekanan dan volume tertentu. jika tekanan sistem diperbesar atau
diperkecil, ada kesetimbangan yang terganggu dan adapula yang tidak
tergangu, tergantung pada jumlah koofisien pereaksi dan hasil reaksi.
Jika tekanan diperbesar atau volume
diperkecil, kesetimbangan akan bergeser ke arah jumlah koefisien yang
kecil. Sebaliknya, jika tekanan diperkecil atau volume diperbesar,
kesetimbangan akan bergeser ke arah jumlah koefisien yang besar. Tetapi,
jika jumlah koefisien pereaksi sama dengan koefisien hasil reaksi,
perubahan tekanan atau volume tidak akan menggeser kesetimbangan.
Perhatikan contoh berikut.
3. hubungan kuantitatif antara pereaksi dan hasil reaksi
Hubungan Kuantitatif antara Pereaksi dan Hasil Reaksi
tetap terdapat hubungan antara konsentrasi pereaksi dan hasil reaksi terhadap tetapan kesetimbangan (K). Kalian akan mengetahui harga tetapan kesetimbangan dengan memahami uraian berikut.
1. Tetapan kesetimbangan berdasarkan konsentrasi (Kc)
Harga K berdasarkan konsentrasi dinyatakan dengan Kc. Rumusan Kc tergantung pada wujud zat dalam kesetimbangan reaksi. Nah, bagaimana cara menentukan harga Kc secara kuantitatif, jika diketahui konsentrasi pereaksi dan hasil reaksi? Kalian tentu masih ingat bahwa Tetapan kesetimbangan berdasarkan konsentrasi (Kc) adalah hasil perkalian konsentrasi hasil reaksi dibagi perkalian konsentrasi pereaksi yang masing-masing dipangkatkan koefisiennya.
Sebelum menentukan harga Kc dari suatu reaksi, simaklah aturan-aturan berikut.
- Harga Kc bisa ditentukan setelah konsentrasi zat-zat dalam kesetimbangan diketahui.
- Konsentrasi zat-zat selalu tertulis dalam satuan molar (mol L-1). Oleh karena itu, perhatikan volume tiap-tiap zat.
- Untuk zat-zat di ruas kiri berlaku hubungan sebagai berikut. Zat pada kesetimbangan = zat mula-mula – zat yang bereaksi Sedangkan untuk zat-zat di ruas kanan berlaku hubungan sebagai berikut:
Zat pada kesetimbangan = zat yang bereaksi pada ruas kiri (zat mulamula biasanya tidak ada).
- Perbandingan mol pada kesetimbangan disesuaikan dengan koefisien tiap-tiap zat.
Perhatikan tabel berikut, agar semakin memahami cara perhitungan harga K pada tiap-tiap reaksi kimia.
 a = mol zat A mula-mula
a = mol zat A mula-mulab = mol zat B mula-mula
c = mol zat A yang bereaksi (terurai)
d = mol zat B yang bereaksi
e = mol zat C yang terbentuk (sama dengan pada saat kesetimbangan)
f = mol zat D yang terbentuk (sama dengan pada saat kesetimbangan)
g = a – c = mol zat A pada kesetimbangan
h = b – d = mol zat B pada kesetimbangan
Perbandingan c : d : e : f sesuai dengan
perbandingan m : n : p : q, sehingga harga c, d, e, dan f disebut jalur
koefisien.Dalam menyelesaikan soal kesetimbangan menggunakan tabel di
atas, perhatikan urutan langkah-langkah berikut:
- Masukkan mol zat yang diketahui dalam soal ke dalam tabel.
- Lengkapi jalur koefisien berdasarkan perbandingan koefisien (baris ke dua).
- Lengkapi mol zat-zat pada kesetimbangan (baris paling bawah).
- Mol zat-zat pada kesetimbangan dibagi volume tiap-tiap zat untuk memperoleh konsentrasi dalam molar.
- Gunakan rumus Kc.
 2. Tetapan Kesetimbangan Parsial (Kp)
2. Tetapan Kesetimbangan Parsial (Kp)
Tetapan kesetimbangan berdasarkan tekanan (Kp)
adalah hasil perkalian tekanan parsial gas-gas hasil reaksi dibagi
dengan perkalian tekanan parsial gas-gas pereaksi yang masing masing
dipangkatkan dengan koofisiennya.
Agar lebih mudah mempelajari tetapan kesetimbangan parsial, perhatikan reaksi berikut:

Pada saat setimbang, gas A, B, C, dan D
bercampur dalam suatu ruangan tertentu dan menimbulkan tekanan yang
disebut tekanan total dari campuran gas-gas tersebut. Sedangkan jika di
dalam ruangan hanya terdapat satu gas dan menimbulkan tekanan, maka
tekanan disebut tekanan parsial. Dengan demikian, jika tekanan total
adalah P dan tekanan gas adalah PA, PB, PC, dan PD maka P = PA + PB + PC
+ PD.
Tekanan parsial berbanding lurus dengan jumlah mol tiap gas. Sehingga tekanan parsial suatu gas dapat ditentukan dengan rumus:
 Sedangkan rumusan Kp untuk reaksi diatas adalah:
Sedangkan rumusan Kp untuk reaksi diatas adalah: Harga Kp dan Kc
suatu kesetimbangan tidak selalu sama, tetapi saling berhubungan,
maksudnya jika konsentrasi dan tekanan parsial salah satu gas diketahui,
maka gas yang lain dapat dihitung.
Harga Kp dan Kc
suatu kesetimbangan tidak selalu sama, tetapi saling berhubungan,
maksudnya jika konsentrasi dan tekanan parsial salah satu gas diketahui,
maka gas yang lain dapat dihitung.Disosiasi merupakan peristiwa penguraian suatu zat menjadi zat lain yang lebih sederhana. Disosiasi termasuk reaksi kesetimbangan, sehingga hasil reaksi penguraian dapat berbalik menjadi pereaksi kembali. Beberapa contoh kesetimbangan disosiasi adalah sebagai berikut:
 Jumlah zat yang terdisosiasi dinyatakan dengan derajat disosiasi. Jadi, derajat disosiasi merupakan perbandingan jumlah mol zat yang terurai dengan jumlah mol zat mula-mula. Derajat disosiasi dilambangkan dengan α.
Jumlah zat yang terdisosiasi dinyatakan dengan derajat disosiasi. Jadi, derajat disosiasi merupakan perbandingan jumlah mol zat yang terurai dengan jumlah mol zat mula-mula. Derajat disosiasi dilambangkan dengan α. Jika α = 0, berarti reaksi tidak berlangsung, dan Jika α = 1, berarti reaksi berlangsung sempurna.
Jika α = 0, berarti reaksi tidak berlangsung, dan Jika α = 1, berarti reaksi berlangsung sempurna.Dalam reaksi kesetimbangan, harga α berada di antara 0 sampai 1 atau 0 < α < 1. Agar lebih mudah memahami perhitungan derajat disosiasi pelajari contoh soal berikut:

5. aflikasi kesetimbangan dalam kehidupan sehari-hari
Aplikasi Kesetimbangan Kimia Dalam Kehidupan Sehari-hari
Aplikasi pada industri – Manfaat Kesetimbangan Kimia
Pada industri kimia, pengontrolan dengan
teliti dari pengaruh laju reaksi dan konsentrasi kesetimbangan berperan
penting dalam metode produksi untuk mendapatkan keuntungan. Kimia dan
teknik kimia mencoba untuk menemukan kombinasi antara proses reaksi dan
kondisi dimana memproduksi produk dalam jumlah besar tetapi dengan
biaya kecil.
Dengan kata lain, metode produksi yang
ditemukan harus memperhitungkan persoalan penting seperti keselamatn dan
pertimbangan lingkungan.
Faktor laju reaksi - Manfaat Kesetimbangan Kimia
Pada umumnya, untuk memproduksi beberapa
jenis zat dalam jumlah banyak, laju reaksi perlu diperhatikan. Faktor
yang mempengaruhi laju reaksi antara lain kenaikan suhu, kenaikan
konsentrasi dari reaktan serta penggunaan katalis.
Secara sekilas, bahwa pabrik kimia harus
dioperasikan pada suhu tinggi dengan menggunakan konsentrasi reaktan
yang tinggi pula sehingga laju reaksi dapat tercapai. Pengaruh faktor
kesetimbangan kimia dan factor ekonomi juga perlu dipertimbangkan oleh
pabrik – pabrik kimia.
Faktor kesetimbangan - Manfaat Kesetimbangan Kimia
Faktor yang mempengaruhi laju reaksi
perlu dipertimbnagkan karena mereka menentukan seberapa cepatnya produk
akan terbentuk. Itu juga factor sangat penting untuk mempengaruhi jumlah
dari pembentukan produk pada kesetimbangan kimia. Jumlah dari reaksi
adalah jumlah / persentase dariproduk yang diperoleh dengan
membandingkannya dengan jumlah maksimal yang seharusnya terbentuk adri
reaksi komplit dari reaktan. Sebagai contoh, jika massa produk yang
terbentuk adalah 5% maka dikatakan produk yang dihasilkan sedikit.
Tetapi, jika massa yang terbentuk 95%, maka dikatakan produk yang
dihasilkan besar. Kondisi suhu dan temperature harus dimanipulasi untuk
mendapatkan produk.
Kondisi – kondisi agar mendapatkan
jumlah produk yang maksimal yaitu kesetimbangan harus berlawanan dengan
laju reaksi maksimal. Sebagai contoh, perubahan sulfur dioksida menjadi
sulfur trioksida.
SO2 (g) + 0,5 O2 SO3 + 99 Kj
Prinsip Le’ Chaterier mengindikasikan
bahwa jumlah produk dari reaksi eksoterm seperti ini akan diperoleh pada
sushu rendah. Tetapi, kecepatan laju maksimal akan diperoleh dengan
suhu tinggi. Denga reaksi seperti ini, para ilmuan harus memilih konisi
reaksi yang menghasilkan kesetimbangan terbaik antara kecepatan laju dan
jumlah maksimal. Pada kasus umum dari reaksi oksidasi SO2,
katalis seperti vanadium pentaooksida dapat digunakan untuk mempercepat
reaksi. Itu sama halnya bahwa laju reaksi maksimal dapat diperoleh pada
suhu sekitar 600 C dengan kesetimbangan terbesar dari SO3 yang didapatkan dengan suhu tinggi.
Faktor ekonomi - Manfaat Kesetimbangan Kimia
Pertimbangan lain yang lebih penting
dalam memilih kondisi reaksi adalah biaya dari penyediaan kondisi
tersebut. Sebagai contoh, untuk menjada suhu reaksi agar tetap tinggi,
memerlukan biaya yang dalam hal ini berupa energy yang dibutuhkan. Jika
katalis yang murah dan cocok dapat ditemukan untuk proses reaksi dan
dapat digunakan dalam jumlah banyak, maka akan menekan biaya produksi.
Penyedia tekanan tinggi untuk reaksi gas
juga diperhitungkan karena tersediaruangan pada bangunan dan menjaga
peralatan. Tekanan tinggi kadang – kadang digunakan untuk memepercepat
laju reaksi dan saat dimana ketersediaan jumlah produk pada
kesetimbnagan. Sebagai contoh, salah satu jenis polietilena dapat
dibentuk dengan menekan gas etilena pada tekana antara 1500 – 2000 atm,
pada suhu 200 C. suhu inidibutuhkan karena reaksi akan terjadi dengan
laju yang wajar.
Proses alternatif menggunakan katalis
special yaitu Ziegler yang dapat membentuk polietilena pada tekanan
lebih rendah sehingga jelas membutuhkan biaya yang lebih sedikit.
Suhu - Manfaat Kesetimbangan Kimia
Karena reaksi berlangsung secara
eksotermik, penerapan prinsip Le’ Chaterier memprediksikan bahwa
banyaknya ammonia yang terbentuk dapat berlangsung pada suhu yang
rendah. Tetapi, pada suhu rendah, laju reaksi berjalan sangat lambat
untuk memproduksi ammonia. Untuk mendapatkan hasil yang layak dengan
laju reaksi yang maksimal, suhu yang digunakan adalah sekitar 500 C.
Tekanan - Manfaat Kesetimbangan Kimia
Produksi ammonia didapatkan dengan
penurunan jumlah dari molekul gas sehingga hasil meningkat pada tekanan
yang lebih tinggi. Tekanan tinggi juga menaikkan laju reaksi. Karena
factor tersebut, proses pembentukan ammonia secara modern pada suhu
tinggi adalah dengan menggunakan tekanan sekitar 350 atm.
Seperti yang telah disebutkan
sebelumnya, suhu yang wajar dapat digunakan dalam proses Haber karena
katalis tersedia, sehingga membuat laju yang wajar berjalan pada suhu
500 C. pada Fe/ FeO, katalis tersedian dalam jumlah sedikit yaitu kalium
oksida dan aluminium oksida adalah katalis yang sering digunakan.
Dengan menggunakan kondisi ini, dimungkinkan untuk menghasilkan ammonia
dalam jumlah besar pada laju biasa dan biaya yang wajar.
Selain konisi ini, hasil yang diperoleh
antara 30 – 40%. Ammonia yang dihasilkan terpecah menjadi nitrogen dan
hydrogen dengan mencairkannya pada tekanan rendah. Nitrogen dan hydrogen
kemudian berekasi kembali.
Pada system respirasi dalam tubuh manusia terdapat sel dengan energy yang dibutuhkannnya.
C6H12O6(aq) + 6CO2(g) ? 6CO2(g) + 6H2O(l) + energi
Proses ini membutuhkan ketersediaan
oksigen yang tetap. Oksigen ditransportasikan ke sel – sel jaringan oleh
sel darah merah melalui aliran darah. Darah juga mengikat protein yang
disebut hemoglobin.
Hemoglobin pada kapiler darah dalam jantung berekasi dengan oksigen untuk membentuk oksihemoglobin.
Haemoglobin(aq) + O2(aq) -> oxyhaemoglobin(aq)
Secara relatif, sebagian tekanan tinggi
(0,20 atm) pada ketersedian oksigen pada reaksi dan rekasi pembentukan
oksihemoglobin. Kemudian ditransportasikan pada sel jaringan yang
mengalir melalui system peredaran darah. Pada tingkat sel, sebagian
oksigen bertekanan rendah yang digunakan untuk berekasi.
Aspek menarik dari hemoglobin dan
oksihemoglobin adalah pengalaman dari para pendaki dan para petualang
pada daerah tinggi. Orang pada ketinggian dapat mengalami letih, sakit
kepala dan gejala lain dari kekurangan oksigen. Sebagai contoh, pada
ketinggian 3 km, tekana parsial oksigen hanya sebesar 0,14 atm. Jumlah
ini tidak dapat digunakan untuk bereaksi, sehingga menghasilkan
konsentrasi oksihemoglobin yang rendah.
Tubuh manusia dapat menyesuaikan iklim
pada ketinggian tertentu dengan cara memproduksi hemoglobin lebih
banyak.dengan prinsip Le’ Chaterier, hal ini dapat membentuk konsentrasi
oksihemoglobin lebih tinggi. Dalam jangka waktu yang lama, pada
ketinggian secara signifikan akan menaikkan kadar hemoglobin dalam
darah. Kadang – kadang , mencapai 50% lebih tinggi daripada individu
yang tinggal di daerah pesisir pantai.
Kesetimbangan hemoglobin dan
oksihemoglobin juga diakibatkan oleh CO, polutan dari asap rokok dan gas
buang kendaraan. CO bereaksi dengan hemoglobin membentuk
carboksihemoglobin.
Haemoglobin(aq) + CO(aq) -> carboxyhaemoglobin(aq)
CO dan oksigen berkompetisi untuk
berikatan dengan hemoglobin. Konstanta kesetimbangan dari
karboksihemoglobin lebih besar dari oksihemoglobin. Sebagai akibatnya,
CO akan lebih mudah berikatan dengan hemoglobin daripada oksigen untuk
kadar CO yang rendah. Kadar CO sekitar 200ppm dapat mngakibatkan pingsan
dan bahkan kematian.

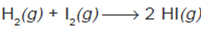



Komentar
Posting Komentar